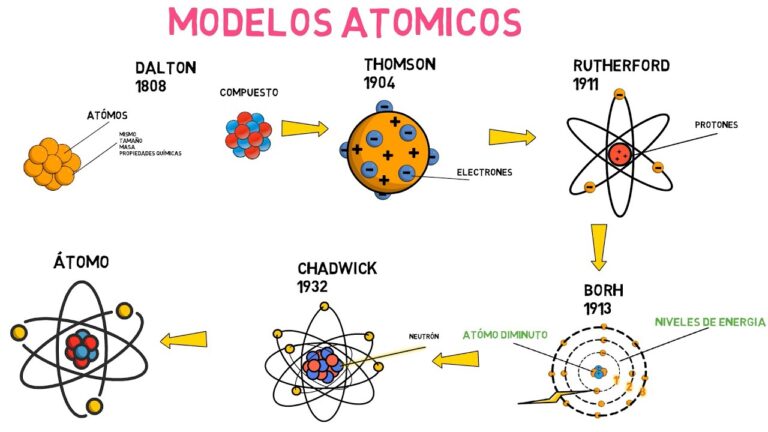
Modelo atómico pdf
En un experimento realizado en 1932, Chadwick, bombardeando berilio con partículas α, observó una radiación desconocida que expulsaba protones del núcleo. Chadwick llegó a la conclusión de que esta radiación estaba compuesta por partículas con una masa aproximadamente igual a la del protón pero sin carga eléctrica, los neutrones. Este descubrimiento fue uno de los más importantes de la física experimental.
Fue nombrado caballero en 1945[5], convirtiéndose en Sir James Chadwick, y miembro de la Orden de Compañeros de Honor en 1970[6]. Recibió la Medalla Copley en 1950 y la Medalla Franklin en 1951.
¿Cuál fue la contribución de Chadwick al modelo del átomo?
Se le conoce sobre todo por el descubrimiento del neutrón en 1932, por el que recibió el Premio Nobel de Física en 1935. Este descubrimiento condujo directamente a la fisión nuclear y a la bomba atómica.
¿Cuál es la conclusión del experimento de James Chadwick?
Este descubrimiento fue extremadamente importante porque explicaba la existencia de los isótopos, átomos de un mismo elemento con el mismo número de protones pero distinto número de neutrones. Como resultado, James Chadwick demostró la existencia del neutrón, respuesta (D).
¿Qué es el modelo de Rutherford del átomo?
Ernest Rutherford propuso entonces un modelo acorde con esta observación: el modelo planetario. Postuló una representación lacunar de la materia en la que los electrones están satelizados alrededor de un núcleo cargado positivamente.
James chadwick
En un experimento realizado en 1932, Chadwick, bombardeando berilio con partículas α, observó una radiación desconocida que expulsaba protones del núcleo. Chadwick llegó a la conclusión de que esta radiación estaba compuesta por partículas con una masa aproximadamente igual a la del protón pero sin carga eléctrica, los neutrones. Este descubrimiento fue uno de los más importantes de la física experimental.
Fue nombrado caballero en 1945[5], convirtiéndose en Sir James Chadwick, y miembro de la Orden de Compañeros de Honor en 1970[6]. Recibió la Medalla Copley en 1950 y la Medalla Franklin en 1951.
Modelo atómico de Rutherford
3010.1: Teoría VSEPR y formas básicas3010.2: Teoría VSEPR y efecto de los dobletes libres3010.3: Predicción de la geometría molecular3010.4: Forma molecular y polaridad3010.5: Teoría del enlace de valencia3010.6: Hibridación de orbitales atómicos I3010.7: Hibridación de orbitales atómicos II
3011.1: Comparación molecular de gases, líquidos y sólidos3011.2: Fuerzas intermoleculares frente a intramoleculares3011.3: Fuerzas intermoleculares3011.4: Comparación de fuerzas intermoleculares: punto de fusión, punto de ebullición y miscibilidad3011. 5: Tensión superficial, capilaridad y viscosidad3011.6: Cambio de estado3011.7: Cambio de estado: vaporización y condensación3011.8: Presión de vapor de saturación3011.9: Ecuación de Clausius-Clapeyron3011. 10: Cambio de estado: fusión y congelación3011.11: Cambio de estado: sublimación y condensación sólida3011.12: Curvas de temperatura de cambio de estado3011.13: Diagramas de fase3011.14: Estructuras sólidas3011. 15: Diferentes redes centradas y números de coordinación3011.16: Sólidos moleculares e iónicos3011.17: Estructuras cristalinas iónicas3011.18: Sólidos metálicos3011.19: Teoría de bandas3011.20: Sólidos covalentes3011.21: Cristalografía de rayos X
Comentarios
Estos resultados se publicaron el 18 de enero de 1932 en una nota en los “Comptes rendus de l’Académie des sciences”. En otra nota, anunciaban que habían podido observar en una cámara Wilson la proyección de protones fuera de una placa de parafina; la trayectoria de estos protones en el aire podía alcanzar 28 cm.
Definamos primero la unidad de energía. El electronvoltio (eV) es la energía adquirida por un electrón acelerado en el vacío por una diferencia de potencial de un voltio. Los múltiplos del electrón voltio se utilizan habitualmente: el kiloelectrón voltio (keV), el megaelectrón voltio (MeV), el gigaelectrón voltio (GeV).
Consideremos en primer lugar el momento angular orbital, que refleja el hecho de que cada nucleón describe movimientos relativos dentro del núcleo. Está cuantificado y sólo puede tomar los valores definidos por :
En el acoplamiento LS o Russel-Saunders, se supone que el acoplamiento del movimiento orbital del nucleón con su espín es débil, y que por otra parte los diferentes nucleones de momento orbital I1, I2, I3… interaccionan fuertemente dando lugar al momento orbital total: L = I1 + I2 + I3 + …